Chromatophore
Les chromatophores sont des cellules pigmentaires ou réfléchissant la lumière présentes dans le tégument de certains animaux.
Recherche sur Google Images :
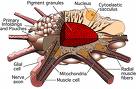
Source image : tolweb.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- Qui porte la couleur, la coloration; Cellule pigmentaire, le plus souvent localisée dans les tissus superficiels, et susceptible de produire chez... (source : fr.wiktionary)
- Histologie cytologie, médecine biologique - N. m. * chromato : du grec khrôma, khrômatos [chroma-, chromat (o) -, -chromie, chrom (o) -], couleur... (source : georges.dolisi.free)

Les chromatophores sont des cellules pigmentaires ou réfléchissant la lumière présentes dans le tégument de certains animaux. Ils sont en grande majorité responsables de la couleur de la peau et des yeux des animaux à sang froid et sont produites par la crête neurale durant le développement embryonnaire. Elles sont localisées à la surface de certains Amphibiens, Poissons, Reptiles, Crustacés et Céphalopodes. Les brusques modifications de couleur des téguments visibles chez certaines espèces sont dues aux variations de taille des chromatophores, à la migration des pigments ou à la réorientation de lamelles réfléchissantes, sous contrôle hormonal, nerveux ou mixte. Ces modifications de couleur sont fréquemment employées comme moyen de camouflage par homochromie, mais peuvent aussi être déclenchées par des variations d'humeur, de température, de nature de l'environnement local, ou par le stress.
Les chromatophores matures sont regroupés en sous-classes selon la couleur (ou plutôt la «teinte») qu'ils possèdent lorsqu'il s sont éclairés par de la lumière blanche : xanthophores (jaune), érythrophores (rouge), iridophores (réfléchissant / iridescent), leucophores (blanc), mélanophores (noir ou brun) et cyanophores (bleu).
À la différence des animaux à sang froid, les Mammifères et les Oiseaux ont leur propre sorte de cellule, le mélanocyte, qui est l'équivalent du mélanophore. Ces derniers sont étudiés par les scientifiques pour comprendre les anomalies de pigmentation humaines et utilisés pour la découverte de médicaments.
Le terme peut aussi se référer aux vésicules colorées associées à la membrane de certaines formes de bactéries phototrophes.
Classification

Des cellules pigmentaires d'Invertébrés sont décrites pour la première fois comme chromoforo dans un journal scientifique italien en 1819. [1] Le terme chromatophore est adopté plus tard comme le nom des cellules pigmentaires dérivées de la crête neurale des Vertébrés à sang froid et des Céphalopodes. Le mot en lui-même provient du grec khrōma (χρωμα) , couleur, et phoros (φορος) , porter. Par contre, le mot chromatocyte (du grec cyte ou κυτε, cellule) a été choisi pour les cellules responsables de la couleur des Oiseaux et des Mammifères. Un seul type de cellule, le mélanocyte, a été identifié chez ces animaux.
Ce n'est qu'à partir des années 1960 que la structure et la coloration des chromatophores fut suffisamment réputée pour permettre l'établissement d'une sous-classification basée sur leur apparence. Cette classification existe toujours actuellement même si des études plus récentes ont révélées que certains aspects biochimiques des pigments peuvent être plus utiles pour comprendre le fonctionnement de ces cellules. [2]
Biochromes et schemochromes
La production de couleur peut être divisée en deux catégories, selon les chromatophores qui la réalisent : coloration par les biochromes et coloration par les schemochromes.
- Les biochromes possèdent des pigments vrais comme les caroténoïdes et les ptéridines. Ces pigments absorbent une partie du spectre visible de la lumière de façon sélective, permettant aux autres longueurs d'onde d'atteindre l'œil de l'observateur.
- Les schemochromes, aussi connus sous l'appellation «couleur structurelle», produisent une coloration en réfléchissant plusieurs longueurs d'ondes (couleurs) de la lumière "blanche" et en transmettant les autres, en provoquant des interférences des ondes lumineuses au sein de leur structure ou décomposant la lumière reçue.
Remarque
Si l'ensemble des chromatophores contiennent des pigments ou des structures réfléchissantes (à moins de subir une mutation génétique génèrant une anomalie comme l'albinisme), l'ensemble des cellules possédant des pigments ne sont pas des chromatophores. L'hème, par exemple, est un biochrome responsable de l'apparence rouge du sang. Il est essentiellement présent dans les globules rouges (érythrocytes), qui sont produits dans la mœlle osseuse tout au long de la vie, et non pas constitués durant le développement embryonnaire. Donc, les érythrocytes ne sont pas classés comme chromatophores.
Les lipophores (xantophores et érythrophores)
Les chromatophores qui contiennent d'importantes quantités de pigments jaunes de ptéridine (xanthoptéridine) sont nommés xanthophores et ceux avec un excès de caroténoïdes rouge/orange sont désignés par le terme érythrophores[2]. On a découvert que les vésicules contenant de la ptéridine et des caroténoïdes étaient fréquemment présentes dans la même cellule, et que la couleur globale dépendait du rapport entre les quantités de pigments jaunes et rouges[3]. De fait, la distinction entre ces deux types de chromatophores est essentiellement arbitraire.
La capacité à produire de la ptéridine à partir de guanosine triphosphate est une caractéristique retrouvée chez la majorité des chromatophores, mais les xanthophores semblent avoir des voies biochimiques supplémentaires qui mènent à une accumulation excessive de xanthoptéridine.
Les caroténoïdes, eux, sont le plus souvent de source alimentaire et sont transportés dans les érythrophores. Cela a été démontré pour la première fois en élevant des grenouilles vertes communes soumises à un régime alimentaire comprenant des criquets à teneur restreinte en carotène. L'absence de carotène dans l'alimentation de la grenouille impliquait que le "filtre" à couleur rouge/orange des caroténoïdes n'était plus présent dans les érythrophores. Le résultat a été que la grenouille est apparue bleue au lieu de verte[4].
Iridophores et leucophores
Les iridophores, ou guanophores, sont des cellules pigmentaires qui réfléchissent la lumière au moyen de lames cristalloïdes de schemochromes produites à partir de guanine cristallisée[5], résidu du catabolisme des acides aminés. À la lumière, elles génèrent des couleurs iridescentes à cause de la diffraction de la lumière sur l'empilement de plaques. L'orientation du schemochrome détermine la nature de la couleur observée[6]. En utilisant les biochromes comme filtres colorés, les iridiophores créent un effet d'optique connu sous le nom d'effet Tyndall ou diffusion Rayleigh, produisant des couleurs brillantes bleues et vertes[7].
Un type de chromatophore proche, les leucophores, sont présents chez plusieurs espèces de poissons. Comme les iridiophores, ils utilisent de la purine cristallisée pour réfléchir la lumière, produisant la couleur blanche éclatante visible chez certains poissons. Comme pour les xanthophores et les érythrophores, la différence entre iridophores et leucophores chez les poissons n'est pas forcément évidente, mais les iridophores sont le plus souvent reconnus comme générant des couleurs iridescentes ou métalliques tandis que les leucophores produisent une couleur réfléchissante dans les tons blancs[7].
Mélanophores
Les mélanophores contiennent un type de mélanine, l'eumélanine, qui apparait noir ou marron foncé grâce à ses qualités d'absorption de la lumière. C'est une molécule complexe contenant des groupements dihydroxyindoles et dihydroxyindole-2-acide carboxylique, avec quelques cycles de type pyrrole[8]. Elle est contenue dans des vésicules, les mélanosomes, et distribués dans toute la cellule. L'eumélanine est produite à partir de tyrosine par une série de réactions chimiques catalysées par des enzymes. L'enzyme clé qui intervient dans la synthèse de la mélanine est la tyrosinase. Quand cette protéine est déficiente, aucune mélanine ne peut être générée, ce qui provoque certains types d'albinisme.
Chez plusieurs espèces d'Amphibiens, il y a d'autres pigments contenus aux côtés de l'eumélanine. A titre d'exemple, un nouveau pigment rouge foncé a été identifié dans les mélanophores de grenouilles de la famille des Phyllomedusinæs[9]. Il a été ensuite identifié comme étant de la ptérorhodine, un dimère de ptéridine qui s'accumule autour de l'eumélanine. S'il est envisageable que des espèces moins étudiées aient des pigments complexes dans leurs mélanophores, il est néanmoins vrai que la majorité des mélanophores étudiés jusqu'ici contiennent seulement de l'eumélanine.
Les humains ont uniquement une sorte de cellule pigmentaire, l'équivalent chez les mammifères des mélanophores, qui produit la couleur de la peau, des cheveux et des yeux : le mélanocyte. Pour cette raison, ainsi qu'à cause de leur grand nombre et de leur contraste de couleurs qui font que ces cellules sont fréquemment facilement repérables, les mélanophores sont de loin les chromatophores les plus étudiés. Cependant, il existe des différences entre la biologie du mélanophore et celle du mélanocyte. En plus de l'eumélanine, les mélanocytes peuvent produire un pigment jaune/rouge nommé la phaéomelanine.
Cyanophores
En 1995, il a été démontré que les couleurs bleu vibrant de plusieurs sortes de poissons mandarins ne sont pas fabriqués par les schemochromes mais par un biochrome cyan de nature chimique inconnue[10]. Ce pigment, trouvé dans les vésicules cellulaires d'au moins deux espèces de poissons de la famille des Callionymidæ, est particulièrement peu habituel dans le règne animal, car l'ensemble des autres colorations bleues étudiées jusqu'désormais sont produites par des schemochromes. Donc un nouveau type de chromatophore, le cyanophore, a été proposé. Quoique peu habituels dans la taxinomie, des cyanophores (mais aussi d'autres chromatophores inhabituels) peuvent être trouvés chez d'autres espèces de poissons et d'amphibiens. A titre d'exemple, des chromatophores brillants aux pigments indéfinis ont été observés dans les familles des Dendrobatidæ et des Centrolenidæ[11].
Translocation du pigment
Énormément d'espèces ont la capacité de faire migrer le pigment au sein des chromatophores, provoquant un changement de couleur. Ce procédé est en particulier étudié au sein des mélanophores, puisque la mélanine est le pigment le plus sombre et le plus visible. Chez la majorité des espèces possédant un derme assez fin, les mélanophores dermiques ont tendance à être plats ainsi qu'à couvrir une grande surface. Cependant, chez les animaux à derme assez épais, comme chez les reptiles adultes, les mélanophores dermiques forment fréquemment des structures tridimensionnelles avec d'autres chromatophores.
Ces structures (ou DCU pour Dermal Chromatophore Units) sont constituées d'une couche supérieure de xanthophores et/ou d'érythrophores, puis d'une couche d'iridophores, et enfin d'une couche de mélanophore en forme de panier avec des prolongements cytoplasmiques recouvrant les iridophores[12].
Dans les deux types de disposition, les mélanophores dermiques sont importants dans le changement de couleur physiologique.
Les mélanophores dermiques plats recouvrent fréquemment les autres chromatophores, ce qui explique que quand le pigment se répand dans la cellule, la peau apparait sombre. Quand le pigment est aggloméré au centre de la cellule, les pigments des autres chromatophores sont exposés à la lumière et la peau prend leur teinte.
De la même manière, après l'accumulation de la mélanine dans les DCUs, la peau apparaît verte de par le filtrage par les xanthophores (jaunes) de la lumière dispersée par la couche d'iridophores. Quand la mélanine se disperse, la lumière n'est plus décomposée; elle est absorbée par la mélanine et la peau apparait sombre.
Comme les autres chromatophores biochromatiques sont aussi capables de réaliser cette migration de pigment, la peau des animaux avec plusieurs sortes de chromatophores peut générer de cette façon un large panel de couleurs[13], [14].

Le contrôle et les mécanismes de la translocation de pigment ont été bien étudiés sur un certain nombre d'espèces, surtout parmi les amphibiens et les poissons téléostéens[15], [16]. Il a été démontré que le processus peut être sous contrôle hormonal, neuronal ou les deux. Les substances neurochimiques qui interviennent dans la translocation de pigment comprennent la noradrénaline, dont les récepteurs se trouvent à la surface des mélanophores[17]. Les hormones principales intervenant dans la régulation de la translocation semblent être la mélanocortine, la mélatonine et l'hormone de mélano-concentration (MCH), produites essentiellement par l'hypophyse, la glande pinéale et l'hypothalamus respectivement. Ces hormones peuvent aussi être fabriquées au moyen d'une régulation paracrine par des cellules de la peau. À la surface du mélanophore, les hormones activent des récepteurs couplés aux protéines G spécifiques qui, alternativement, transmettent un signal à la cellule. La mélanocortine provoque la dispersion des pigments, alors que la mélatonine et la MCH déclenchent leur agrégation[18].
De nombreux récepteurs de mélacortine, de MCH et de mélatonine ont été identifiés sur les poissons[19] et les grenouilles[20], dont un homologue du M1CR [21], un récepteur de la mélacortine réputé pour réguler la couleur de la peau et des cheveux des humains[22]. Au sein de la cellule, l'adénosine monophosphate cyclique (AMPc) est un important messager secondaire de la translocation de pigment. Par un mécanisme toujours imparfaitement décrypté, l'AMPc influence d'autres protéines, comme la protéine kinase A, pour activer le moteur protéique qui transporte les vésicules contenant les pigments le long des microtubules et des microfilaments. [23], [24], [25]
Adaptation
- voir aussi : Mimétisme
La plupart des poissons, des reptiles et des amphibiens changent de couleur en réponse à des modifications dans leur environnement. Ce type de camouflage, ou homochromie, se manifeste le plus souvent par un léger obscurcissement ou éclaircissement de la peau pour imiter approximativement l'environnement immédiat. Il a été démontré que ce procédé dépend de la vision (l'animal doit pouvoir voir son environnement pour s'y adapter[26]), et que la translocation de la mélanine dans les mélanophores est le principal facteur responsable du changement de couleur[27]. Des animaux comme les caméléons, les céphalopodes et les lézards anoles ont une réponse adaptative particulièrement développée capable de générer particulièrement rapidement de nombreuses couleurs différentes. Ils ont adapté leur capacité à changer de couleur en réponse aux variations de températures, d'humeur, de stress et les interactions sociales, plutôt que pour seulement imiter leur environnement.
Développement
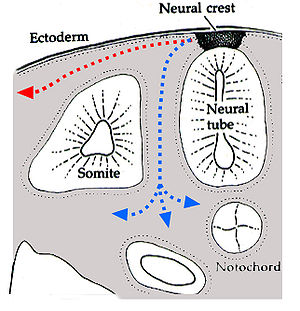
Au cours du développement embryonnaire des Vertébrés, les chromatophores sont l'un des types de cellules produites dans la crête neurale, qui est une bande de cellules apparaissant sur les bordures du tube neural. Ces cellules ont la capacité de migrer sur de longues distances, permettant aux chromatophores de peupler de nombreux organes du corps, dont la peau, l'œil, l'oreille et le cerveau. Quittant la crête neurale par vagues successives, les chromatophores prennent soit un chemin dorsolatéral à travers le derme, entrant dans l'ectoderme par de petits espaces localisés dans la lame basale, soit un chemin médioventral entre les somites et le tube neural. Les mélanophores de l'épithélium pigmenté de la rétine de l'œil forment une exception. Ils ne sont pas issus de la crête neurale mais d'un diverticule du tube neural, qui génère la cupule optique qui, à son tour, formera la rétine.
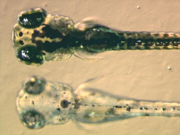
Lorsque et comment les cellules multipotentes précurseurs des chromatophores, nommées chromatoblastes, se différencient pour obtenir les différents types de chromatophores est en cours de recherche. On sait que dans l'embryon de poisson zèbre, par exemple, trois jours après la fécondation, chacun des types de chromatophores retrouvés chez l'adulte (mélanophores, xanthophores et iridophores) sont déjà présents. Des études employant un poisson mutant ont démontré que les, tel que kit , sox10 et jouent un rôle important dans la différenciation des chromatophores[28]. Si ces protéines sont déficientes, les chromatophores peuvent être localement ou totalement absents, aboutissant à un problème de leucistisme.
Applications pratiques
En plus de la recherche principale pour mieux comprendre le fonctionnement des chromatophores, les cellules sont aussi utilisées en recherche appliquée. A titre d'exemple, la larve du poisson zèbre est étudiée pour comprendre comment les chromatophores s'organisent et communiquent pour former les rayures horizontales régulières observables chez l'adulte[29]. Ces larves sont reconnues comme un modèle utile pour mieux comprendre l'évolution du développement embryonnaire.
La biologie des chromatophores est aussi utilisée pour modéliser certaines affections humaines, comme le mélanome ou l'albinisme. Il y a peu de temps, on a découvert que le gène responsable de la spécificité des mélanophores dans la, Slc24a5 , avait un équivalent chez l'humain qui présente une forte corrélation avec la couleur de la peau[30].
Les chromatophores sont aussi utilisés comme biomarqueur de la cécité chez les espèces à sang froid, car les animaux présentant certains types de déficience visuelle ne parviennent pas à réaliser l'homochromie[26]. On pense que des homologues chez l'humain des récepteurs intervenant dans la translocation de pigment des mélanophores interviendraient dans la suppression de l'appétit et dans le bronzage, en faisant des cibles attrayantes pour la recherche pharmaceutique[31]. Par conséquence, les compagnies pharmaceutiques ont développé des tests biologiques pour identifier rapidement les composés bioactifs potentiels en utilisant les mélanophores d'un crapaud africain (Xenopus lævis) [32].
D'autres scientifiques ont développé des techniques pour utiliser les mélanophores comme biosenseurs [33], et pour une détection rapide de la coqueluche (basée sur la découverte que la toxine de la coqueluche bloque l'agrégation de pigment dans les mélanophores de poissons) [34].
Des applications militaires potentielles concernant les changements de couleur des chromatophores ont été proposée, essentiellement comme type de camouflage actif[35].
Cas des Céphalopodes

Les céphalopodes de la sous-classe des Coleoidea ont des'organes'multicellulaires complexes qu'ils utilisent pour changer de couleur rapidement. C'est spécifiquement notable chez les calmars, seiches et pieuvres aux couleurs vives. Chaque unité de chromatophores se compose d'une seule cellule pigmentaire et de nombreuses cellules musculaires, nerveuses, et gliales (entre autres des cellules de Schwann) [36]. Au sein de la cellule du chromatophore, des granules de pigments sont enfermés dans un sac élastique, le sacculus cytoélastique. Pour changer de couleur, l'animal déforme le sacculus pour qu'il change de forme ou de taille par contraction musculaire, modifiant ainsi sa transluminescence, sa réflectivité ou son opacité. Ce mécanisme diffère de celui rencontré chez les poissons, amphibiens et reptiles, car il ne fait pas intervenir une translocation des vésicules de pigment au sein de la cellule mais un changement de forme du sacculus. Cependant l'effet est le même.
Les poulpes actionnent leurs chromatophores par vagues, obtenant une manifestation chromatique complexe et de rapides changements de couleurs. On pense que les nerfs commandant les chromatophores seraient localisés dans le cerveau, dans une position identique aux chromatophores qu'ils contrôlent. Cela veut dire que l'ordre dans lequel s'effectue le changement de couleur correspond à l'ordre dans lequel se fait l'activation neuronale. Ceci expliquerait pourquoi le changement de couleur se produit par vagues, parce que les neurones sont activés l'un après l'autre[37]. Comme le caméléon, les céphalopodes utilisent le changement de couleur dans leurs interactions sociales. Ils sont aussi parmi les plus compétents en matière d'homochromie, ayant la capacité d'adapter leur couleur et leur texture à l'environnement local avec une remarquable précision.
Bactérie
Des chromatophores peuvent aussi être trouvés dans la membrane des bactéries phototrophes. Utilisés essentiellement pour la photosynthèse, ils contiennent des pigments de chlorophylle bactérienne (chlorophylle a et d) et des caroténoïdes[38]. Chez les bactéries pourpres, par exemple Rhodospirillum rubrum , les antennes collectrices sont intrinsèques aux membranes chromatophores. Cependant, chez les bactéries Chlorobiaceæ, elles sont arrangées sous forme d'antennes collectrices spécialisées, les chlorosomes [39].
- ↑ Sangiovanni G. Descrizione di un particolare sistema di organi cromoforo espansivo-dermoideo e dei fenomeni che esso produce, scoperto nei molluschi cefaloso. G. Enciclopedico Napoli. 1819; 9 :1–13.
- ↑ a b Bagnara JT. Cytology and cytophysiology of non-melanophore pigment cells. Int Rev Cytol. 1966; 20 :173–205. PMID 5337298
- ↑ Matsumoto J. Studies on fine structure and cytochemical properties of erythrophores in swordtail, Xiphophorus helleri. J Cell Biol. 1965; 27 :493–504. PMID 5885426
- ↑ Bagnara JT. Comparative Anatomy and Physiology of Pigment Cells in Nonmammalian Tissues in The Pigmentary System : Physiology and Pathophysiology, Oxford University Press, 1998. ISBN 0-19-509861-7
- ↑ Taylor JD. The effects of intermedin on the ultrastructure of amphibian iridophores. Gen Comp Endocrinol. 1969; 12 :405-16. PMID 5769930
- ↑ Morrison RL. A transmission electron microscopic (TEM) method for determining structural colors reflected by lizard iridophores. Pigment Cell Res. 1995; 8 :28–36. PMID 7792252
- ↑ a b Fujii R. The regulation of motile activity in fish chromatophores. Pigment Cell Res. 2000; 13 :300-19. PMID 11041206
- ↑ Ito S & Wakamatsu K. Quantitative analysis of eumelanin and pheomelanin in humans, mice, and other animals : a comparative review. Pigment Cell Res. 2003; 16 :523-31. PMID 12950732
- ↑ Bagnara JT et al. Color changes, unusual melanosomes, and a new pigment from leaf frogs. Science. 1973; 182 :1034–5. PMID 4748673
- ↑ Fujii R. The regulation of motile activity in fish chromatophores. Pigment Cell Res. 2000; 13 :300-19. PMID 11041206
- ↑ Schwalm PA et al. Infrared reflectance in leaf-sitting neotropical frogs. Science. 1977; 196 :1225–7. PMID 860137
- ↑ Bagnara JT et al. The dermal chromatophore unit. J Cell Biol. 1968; 38 :67–79. PMID 5691979 Full textPDF
- ↑ Palazzo RE et al. Rearrangements of pterinosomes and cytoskeleton accompanying pigment dispersion in goldfish xanthophores. Cell Motil Cytoskeleton. 1989; 13 :9–20. PMID 2543509
- ↑ Porras MG et al. Corazonin promotes tegumentary pigment migration in the crayfish Procambarus clarkii. Peptides. 2003; 24 :1581–9. PMID 14706537
- ↑ Deacon SW et al. Dynactin is required for bidirectional organelle transport. J Cell Biol 2003; 160 :297-301. PMID 12551954 Texte complet
- ↑ Fujii R. The regulation of motile activity in fish chromatophores. Pigment Cell Res. 2000; 13 :300-19. PMID 11041206
- ↑ Aspengren S et al. Noradrenaline- and melatonin-mediated regulation of pigment aggregation in fish melanophores. Pigment Cell Res. 2003; 16 :59–64. PMID 12519126
- ↑ Logan DW et al. Regulation of pigmentation in zebrafish melanophores. Pigment Cell Res. 2006; 19 :206-13. PMID 16704454
- ↑ Logan DW et al. Sequence characterization of teleost fish melanocortin receptors. Ann N Y Acad Sci. 2003; 994 :319-30. PMID 12851332
- ↑ Sugden D et al. Melatonin, melatonin receptors and melanophores : a moving story. Pigment Cell Res. 2004; 17 :454-60. PMID 15357831
- ↑ Logan DW et al. The structure and evolution of the melanocortin and MCH receptors in fish and mammals. Genomics. 2003; 81 :184-91. PMID 12620396
- ↑ Valverde P et al. Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans. Nat. Genet. 1995; 11 :328-30. PMID 7581459
- ↑ Snider J et al. Intracellular actin-based transport : how far you go depends on how often you switch. Proc Natl Acad Sci USA. 2004; 101 :13204-9. PMID 15331778 Full text
- ↑ Rodionov VI et al. Functional coordination of microtubule-based and actin-based motility in melanophores. Curr Biol . 1998; 8 :165-8. PMID 9443917 Texte complet
- ↑ Rodionov VI et al. Protein kinase A, which regulates intracellular transport, forms complexes with molecular motors on organelles. Curr Biol. 2002; 14 :1877–81. PMID 15498498 Texte complet
- ↑ a b Neuhauss SC. Behavioral genetic approaches to visual system development and function in zebrafish. J Neurobiol. 2003; 54 :148-60. PMID 12486702. [pdf].
- ↑ Logan DW et al. Regulation of pigmentation in zebrafish melanophores. Pigment Cell Res. 2006; 19 :206-13. PMID 16704454
- ↑ Kelsh RN et al. Genetic analysis of melanophore development in zebrafish embryos. ] Dev Biol. 2000; 225 :277-93. PMID 10985850
- ↑ Kelsh RN. Genetics and evolution of pigment patterns in fish. Pigment Cell Res. 2004; 17 :326-36. PMID 15250934
- ↑ Lamason RL et al. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science. 2005; 310 :1782–6. PMID 16357253
- ↑ Logan DW et al. The structure and evolution of the melanocortin and MCH receptors in fish and mammals. Genomics . 2003; 81 :184-91. PMID 12620396.
- ↑ Jayawickreme CK et al. Use of a cell-based, lawn format assay to rapidly screen a 442, 368 bead-based peptide library. J Pharmacol Toxicol Methods. 1999; 42 :189-97. PMID 11033434
- ↑ Andersson TP et al. Frog melanophores cultured on fluorescent microbeads : biomimic-based biosensing. Biosens Biœlectron. 2005; 21 :111-20. PMID 15967358
- ↑ Karlsson JO et al. The melanophore aggregating response of isolated fish scales : a very rapid and sensitive diagnosis of whooping cough. FEMS Microbiol Lett. 1991; 66 :169-75. PMID 1936946
- ↑ Lee I. Nanotubes for noisy signal processing : Adaptive Camouflage PhD Thesis. 2005; University of Southern California. [pdf].
- ↑ Cloney RA. & Florey E. Ultrastructure of cephalopod chromatophore organs. Z Zellforsch Mikrosk Anat. 1968; 89 :250–280. PMID 5700268
- ↑ Demski LS. Chromatophore systems in teleosts and cephalopods : a levels oriented analysis of convergent systems. Brain Behav Evol. 1992; 40 :141-56. PMID 1422807
- ↑ Salton MR. Bacterial membrane proteins. Microbiol Sci. 1987; 4 :100-5. PMID 3153178
- ↑ Frigaard NU. & Bryant DA. Seeing green bacteria in a new light : genomics-enabled studies of the photosynthetic apparatus in green sulfur bacteria and filamentous anoxygenic phototrophic bacteria. Arch Microbiol. 2004; 182 :265-75. PMID 15340781
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 11/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité